蛍光顕微鏡の基本原理は、蛍光色素を用いて細胞成分を特異的に可視化することです。この蛍光色素は、例えばGFPのような蛍光タンパク質で、標的タンパク質と遺伝的に結合しています。クローニングが不可能な場合(組織学的サンプルなど)には、蛍光免疫染色などの技術を用いて目的のタンパク質を可視化します。蛍光色素と結合した抗体を利用し、直接または間接的に適切なターゲット構造に結合させます。蛍光色素を用いることで、タンパク質だけでなく、核酸、糖鎖、その他の構造物の検出も可能となります。また、オルガネラ選択的染色試薬によるオルガネラの可視化(例:ER、ミトコンドリア、ゴルジ体)や、生細胞トラッキング、ラベリング、細胞増殖、生死判定などの機能アッセイなど、アプリケーションに応じて様々な生細胞向けの色素を使用することができます。カルシウムイオンのような非生物学的物質でも検出することが可能です。この記事では、一般的に使用される蛍光色素について紹介します。
免疫蛍光法
蛍光顕微鏡法では、標的タンパク質を可視化のに2つの方法があります。一つは、標的タンパク質に蛍光タンパク質を遺伝子的に結合する方法、もう一つは、標的タンパク質に特異的に結合する蛍光標識された抗体を利用する方法です。生物学的な問題によっては、後者の方がより有用であったり必要とされる場合があります。例えば組織標本は、一般的に蛍光タンパク質などは保有しない生物試料ですから、蛍光標識された抗体を使うしかありません。また、蛍光免疫染色法は、標的遺伝子をクローニングし細胞にDNAをトランスフェクションする、といった手順を踏む蛍光タンパク質よりも、はるかに高速に実施することができます。蛍光タンパク質には、それ自身がタンパク質であるという弱点もあります。細胞内でそのタンパク質の特性を持つため、結合した標的タンパク質の機能障害や誤認識を引き起こす可能性があるということです。しかし、生きた細胞を研究するためには、蛍光タンパク質を使用する方法が選択されることもあるということを考慮する必要があります。
免疫蛍光法は、抗体の抗原に対する非常に特異的な結合親和性を利用するものです。これには2つの異なるアプローチがあります。最も簡単な方法は、標的タンパク質に結合する蛍光標識抗体を1つだけ使用する方法です。これは直接免疫蛍光法と呼ばれます。多くの場合、形態の異なる2つの抗体を使用します。1つ目は一次抗体と呼ばれ、それ自身は蛍光標識されていない標的タンパク質に結合する抗体です。次に、一次抗体に特異的に結合する抗体は二次抗体と呼ばれ、蛍光色素で標識されています。この方法は間接免疫蛍光法と言い、いくつかの利点があります。一次抗体に複数の二次抗体が結合し、増幅効果があるという点です。また、一般的には、蛍光色素で標識された特定の一次抗体よりも、二次抗体を見つけることの方が容易ということが挙げられます。以下では、最も一般的に使用されている蛍光色素について概説します。
FITCおよびTRITC
フルオレセインイソチオシアナート(FITC)は有機蛍光色素であり、おそらく免疫蛍光法やフローサイトメトリーで最も一般的に使用される蛍光色素の1つです。励起波長は 495nm、蛍光波長は 517nmにスペクトルのピークを有し、タンパク質のアミノ基、スルフヒドリル基、イミダゾイル基、チロシル基またはカルボニル基に結合しているその反応性イソチオシアナート基の助けを借りて、異なる抗体と結合することができます。FITCは、蛍光顕微鏡観察に使用され、Alexa Fluor®488のような他の蛍光色素の前駆体となった最初の色素の1つです。その蛍光活性は、大きな共役芳香族電子系に起因し、青色スペクトルの光で励起されます。
図1:ショウジョウバエの胚発生、緑:FITC、赤:TRITC
FITCとの併用に多用される色素はTRITC(Tetramethylrhodamine-5-(および6)-isothiocyanate)です。FITCとは対照的に、TRITCはフルオレセインではなくローダミンファミリーの誘導体です。ローダミンは大きな共役芳香族電子系を持ち、これが蛍光性を発揮します。TRITCは緑色スペクトルで励起され、そのピークは550nmにあります。一方、蛍光スペクトルのピークは573nmにあります。また、タンパク質(抗体など)との結合は、反応性の高いイソチオシアネート基をベースにしています。FITCおよびTRITCは依然として広く使用されていますが、かなり弱い蛍光色素であり、最新の顕微鏡観察では推奨されません。
シアン系
FITCとの併用に多く利用される色素は、TRITC(Tetramethylrhodamine-5-(および6)-isothiocyanate)です。FITCとは対照的に、TRITCはフルオレセインではなくローダミンファミリーの誘導体です。ローダミンは大きな共役芳香族電子系を持ち、これが蛍光性を発揮します。TRITCは緑色スペクトルで励起され、そのピークは550nmにあります。一方、蛍光スペクトルのピークは573nmにあります。また、タンパク質(抗体など)との結合は、反応性の高いイソチオシアネート基をベースにしています。FITCおよびTRITCは依然として広く使用されていますが、かなり弱い蛍光色素であり、最新の顕微鏡観察では推奨されません。
Alexa Fluor®色素は、負電荷を帯びた親水性の蛍光色素からなる大きなグループで、蛍光顕微鏡で頻繁に使用されています。すべてのAlexa Fluor®色素は、フルオレセイン、クマリン、シアニンまたはローダミン(Alexa Fluor®546、Alexa Fluor®633など)などの異なる塩基性蛍光物質のスルホン化形態です。それぞれの励起波長は、それらの標識に記載されています。例えば、最も一般的に使用されている色素の一つであるAlexa Fluor®488は、標準的な488nmのレーザーで励起することができ、493nmに励起極大があり、519nmに蛍光極大があります。これはフルオレセイン誘導体でFITCと同様の特性を有しています。しかし、より良い安定性、輝度、低いpH感度を示します。
図2:トランスジェニックマウス初期胚(E10.5)、肢間体節、5つの肢間体節:EpaxialMyf5 eGFP(GFP-Alexa 488、免疫染色)、胚性筋線維(Desmin-Cy3)、核(Hoechst)、3.5 mm (a)、800 µm (b) データ提供;Aurélie Jory,Cellules Souches et Développement,Institut Pasteur,Paris,France and IGBMC,Imaging centre of IGBMC
図3:マウス線維芽細胞;緑(F-Actin、FITC)、赤(チューブリン、Cy5)、青(核、DAPI)データ提供;Dr. Günter Giese, Max Planck Institute for Medical Research, Heidelberg, Germany.
DNA染色
蛍光顕微鏡を使って核酸を研究したい場合、たとえば、核の検出によって細胞の正確な位置や数を決めます。最も一般的なDNA染色の1つはDAPI(4′,6-ジアミジノ-2-フェニルインドール)であり、DNA二重らせんのA-Tリッチな領域に結合します。DAPIの蛍光強度は、DNAに結合していない状態に比べて増加します。紫外線によって励起され、ピークは358nmにあります。蛍光スペクトルはブロードに広がり、461nmが蛍光極大です。弱いシグナルで、RNA結合を検出することもできます。この場合、蛍光波長は500nmにシフトします。興味深いことに、DAPIは無傷の細胞膜を透過できるため、固定細胞と生細胞の両方に利用可能です。次に広く用いられているDNA染色の色素は、ヘキスト・ファミリーです。Hoechst 33258, Hoechst 33342, Hoechst 34580は、A-Tリッチな領域にインターカレートする性質を持つビスベンゾイミドです。DAPIと同様に紫外線で励起され、455nmに蛍光極大を持ちますが、非結合状態では510-540nmにシフトします。また、Hoechst染色も細胞透過性であるため、固定細胞と生細胞の両方に使用することができ、DAPIよりも低い毒性を示します。
膜不透過性のDNA染色剤としてはプロピジウム-ヨウ化物があり、無傷の細胞には入ることができないため、培養細胞の生死判定によく使われます。プロピジウム-ヨウ化物もインターカレート剤ですが、明確な塩基に対する結合優先性はありません。核酸が結合した状態では、538nmに励起極大を持ちます。蛍光極大は617nmです。結合していないプロピジウム-ヨウ化物の励起および蛍光極大は、低波長・低強度にシフトします。また、その蛍光特性を変えることなくRNAに結合することもできます。DNAとRNAを区別するためには、十分なヌクレアーゼを用いる必要があります。DNAとRNAを区別する色素として、アクリジンオレンジがあります。その励起・蛍光極大の組み合わせは、DNA結合型では502 nm/525 nm、RNA結合型では460 nm/650 nmに転じます。さらに、陽イオン性色素がプロトン化されるリソソームのような酸性区画にも入ることができます。この酸性の環境では、アクリジンオレンジは青色スペクトルの光で励起され、オレンジ色の領域で最も強く蛍光を発します。酸性のコンパートメントを多く持つことから、アポトーシス細胞の識別によく使われます。
コンパートメントや細胞小器官特異的な色素
リソソーム、エンドソームまたはミトコンドリアのようなオルガネラのような細胞コンパートメントを研究するための特異的な色素が多く存在します。ミトコンドリアを観察する1つの周知の方法は、MitoTracker®の利用です。これは、チオール反応性に優れたクロロメチル基を持つ細胞透過性色素で、システイン残基の遊離チオール基と反応してマトリックスタンパク質に共有結合します。MitoTracker® には、さまざまな色や形状のものがあります(Table1:リンク先下部の表参照)。ローダミン123やテトラメチルロサミンのような通常のミトコンドリア特異的染色とは対照的に、MitoTracker®は固定剤で膜電位を破壊した後は洗い流されません。LysoTrackerは、リソソームのような酸性の区画を染色するために用いられる様々な色で利用可能な色素群です。これらは、フルオロフォアに結合した膜透過性の弱い塩基で、おそらくこれらの塩基は、プロトン化(Table1:リンク先下部の表参照)が理由で酸性区画に親和性を持ちます。
リソソームに匹敵する区画として、出芽酵母Saccharomyces cerevisiaeのような菌類では液胞があります。この膜で囲まれた空間は、酸性の性質をもっています。蛍光顕微鏡で可視化する1つの方法は、FM4-64®またはFM5-95®のようなスチリルベースの色素の使用です。小胞体(ER)は通常、タンパク質分泌を研究する際に染色されます。この区画を染色する古典的な色素の一つがDiOC6(3)で、ERを好みますがミトコンドリアのような他の膜にも結合します。ERを特異的に染色するもう一つの方法は、ER-Tracker GreenやRedのようなER-Trackerを用いることです。どちらもBODIPYベースの色素で、スルホニル尿素であるグリベンクラミドと結合し、小胞体膜に専有しているATP感受性カリウムチャネルに結合します。BODIPY(ボロン‐ジピロメテン)は、pHに比較的敏感で、ほとんど水に溶けない染料のグループです。そのため、脂質や膜の標識に非常に適したツールとなります。
図4:プルキンエ細胞、マウス小脳皮質の三重標識傍矢状断 赤:抗カルビンジン-D28k/Cy3、緑:抗GFAP/Cy5、青:Hoechst 33258
図5:ウシ肺内皮細胞 赤;ミトコンドリア(MitoTracker® Red CMXRos)、 緑;F-actin(緑色BODIPY® FL phallacidin)、青;(核、DAPI)この画像は3Dブラインドデコンボリューションで強調されています。
小胞体に隣接する区画-ゴルジ装置-は、NBD C6-セラミドやBODIPY FL C5-セラミドのような蛍光セラミド類似体で標識することができます。セラミドは、ゴルジ装置に高度に濃縮されたスフィンゴ脂質です。さらに脂質ベースの色素を用いると、リピッドラフトのような特殊な膜領域を染色することが可能です。NBD-6 CholestrolやNBP-12 Cholesterolなどを用いることで、これらのコレステロールに富んだドメインを可視化することができます(Avanti Polar Lipids)。また、細胞内の異なる場所に好んで存在するタンパク質の助けを借りて、目的の場所を染色することも可能です。例えば、細胞膜に存在するシアル酸やN-アセチルグルコサミニルに特異的に結合する小麦胚芽アグルチニン(WGA)の利用が挙げられます。
イオンイメージング
神経細胞、遺伝子の活性化、細胞の運動などを研究する場合、細胞のイオン濃度を調べることは興味深いことです。ナトリウム、カルシウム、塩化物またはマグネシウムイオンは、多くの異なる細胞事象に深く影響します。一般に、イオンは適切なイオンと結合するとスペクトル特性が変化する蛍光標識キレート剤の助けを借りて捕捉することができます。標識化キレート剤の例として、カルシウムインジケーターfura-2、indo-1、fluo-3、fluo-4およびCalcium-Greenがあります。ナトリウム検出には、一般的にSBFI(ナトリウム結合ベンゾフルザニソフタレート)またはSodium Greenが用いられます。PBFI(カリウム結合ベンゾフルザニソフタレート)は、カリウムイオンを検出します。
機能的アッセイ
機能的アッセイとは、蛍光マーカーで可視化できる様々な機能を評価するための、標準的な実験を広く指す言葉です。これらのマーカーには、上述した標識技術や蛍光色素のいずれかが含まれますが、これらに限定されるものではありません。これらの機能的アッセイの多くのために、染色キットが市販されており、膨大な種類の試料に容易に適用することができます。機能的アッセイの例で一般的に知られており広く使用されているものには、生死アッセイがあります。2つの蛍光色素を利用して、生細胞と死細胞を標識することができます。この2つの数値が揃えば、細胞の健康状態を総合的に評価することができます。さらに、この情報とマーカーを関連づけることで、その背景の解明が進むかもしれません。
蛍光色素とその励起・蛍光波長ピーク
Table1:リンク先下部の表は、蛍光色素の励起波長と蛍光波長のピークの一覧です。これらのピークの他に、すべての色素は明確な励起スペクトルと蛍光スペクトルを特徴としていることに注意してください。1つの実験に複数の色素を組み合わせて使用する場合、クロストーク(またはブリードスルー)によって励起スペクトルと蛍光スペクトルが重なり、誤陰性または誤陽性の原因となったり、データが不明瞭になったりすることに注意する必要があります。また、蛍光イメージングの結果を歪める原因として、細胞や組織に自然に存在する自家蛍光があり、これは植物や藻類を用いた実験では特に注意が必要です。また、励起用の光源(LED、アーク灯、レーザーなど)と蛍光用のフィルターや検出器を適切に選択するには、試料に使用されている色素のスペクトルをよく理解することが重要です。
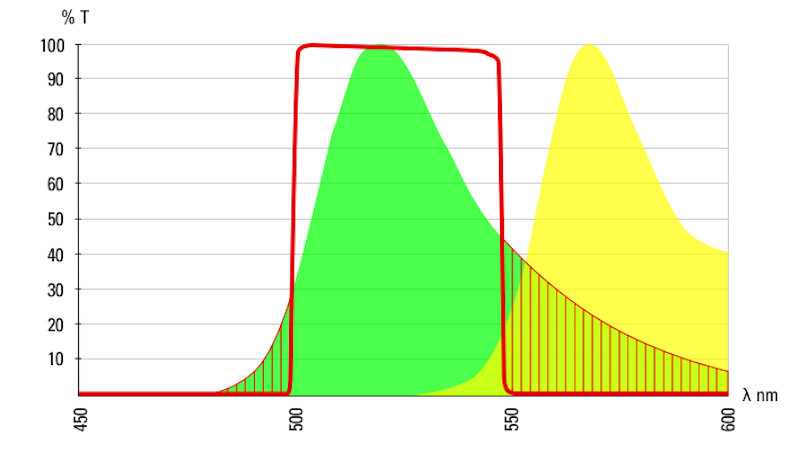
図6:Alexa488(緑の曲線)およびAlexa555(黄の曲線)の蛍光プロファイル。2つの蛍光スペクトルの重なりが一目瞭然です。赤線は、488蛍光フィルタのバンドパスを示しています。
ライカは、お客様のご研究に合った蛍光イメージングソリューションをご提案いたします。ぜひ、お気軽にお問い合わせください!
- 世界初のイメージング・マイクロハブ
- Mica
スクリーニングから超解像まであらゆる用途の蛍光イメージングとAIによる画像解析、インキュベーターを1つのシステムに統合した、All in oneワークフローソリューション。ライカ独自の技術で高精細画像を高速に取得、さらにシンプルな設定・操作ですべての研究者が簡単に画像を取得できます。