本記事では、軸索身長阻害剤(AGI)タンパク質の活性を抑制する化合物を投与したマウスの脊髄組織切片を用いて実施された、損傷を受けた神経の再生に関する評価について紹介します。脳や脊髄の損傷を受けた神経は再生できないことがしばしばありますが、AGIを抑制することで軸索の再生が進み、神経機能が向上することが示唆されました。また、従来の蛍光顕微鏡観察とTHUNDERイメージャーを使って軸索の活性および非活性をスクリーニングしてみると、THUNDER画像では活性化した軸索と非活性の軸索をより明確に識別することが可能であることが明らかとなりました。損傷を受けた神経接続の回復のためのアプローチを効率的に評価することで、より有効な治療法の発見を促進することが期待されます。
はじめに
脊髄損傷(SCI)、脳卒中、外的脳損傷(TBI)、多発性硬化症(MS)など外傷や疾患の後、軸索の再生や神経の再形成ができない場合、患者の予後は思わしくないものとなり得ることが知られています[1-3]。一方で、ミエリン関連阻害因子(Nogo、MAG、OMgp)、コンドロイチン硫酸プロテオグリカン(CSPGs)という、軸索の成長を抑制する2種類の軸索成長抑制因子(AGI)タンパク質が同定されています[1]。生体内でこれらの阻害剤の活性を抑制する実験においては、損傷を受けた軸索の再生がわずかに増加する一方で、それ以上に劇的な機能回復が起こることが明らかとなりました[2]。この時、物理的に距離のある軸索再生による機能回復の代わりとして、SCI後にしばしば見受けられる、損傷の無い脊髄回路の再形成があるということが考えられます [3]。損傷を受けていない無傷の脊髄回路が、切れてしまった既存の軸索の機能を補う可能性があり、また、AGIの作用を阻害することが軸索の再形成を補助する可能性があることを検証する、これも一連の研究の中で実証される必要があります。そこで、本研究では、活性化した軸索と非活性の軸索のスクリーニングを従来の蛍光顕微鏡とTHUNDERイメージャーとで実施し、その作業効率を比較しました。
方法
検体;蛍光標識したマウス脊髄切片
検証;AGIの作用を抑制した部位で活性化している軸索をカウントし、その有効性を判断した。
イメージングシステム;THUNDERイメージャー 3D 組織切片
対物レンズ;PL APO 10X/0.45
カメラ;DFC9000 GT (sCMOSカメラ)
Zスタック;10枚
結果
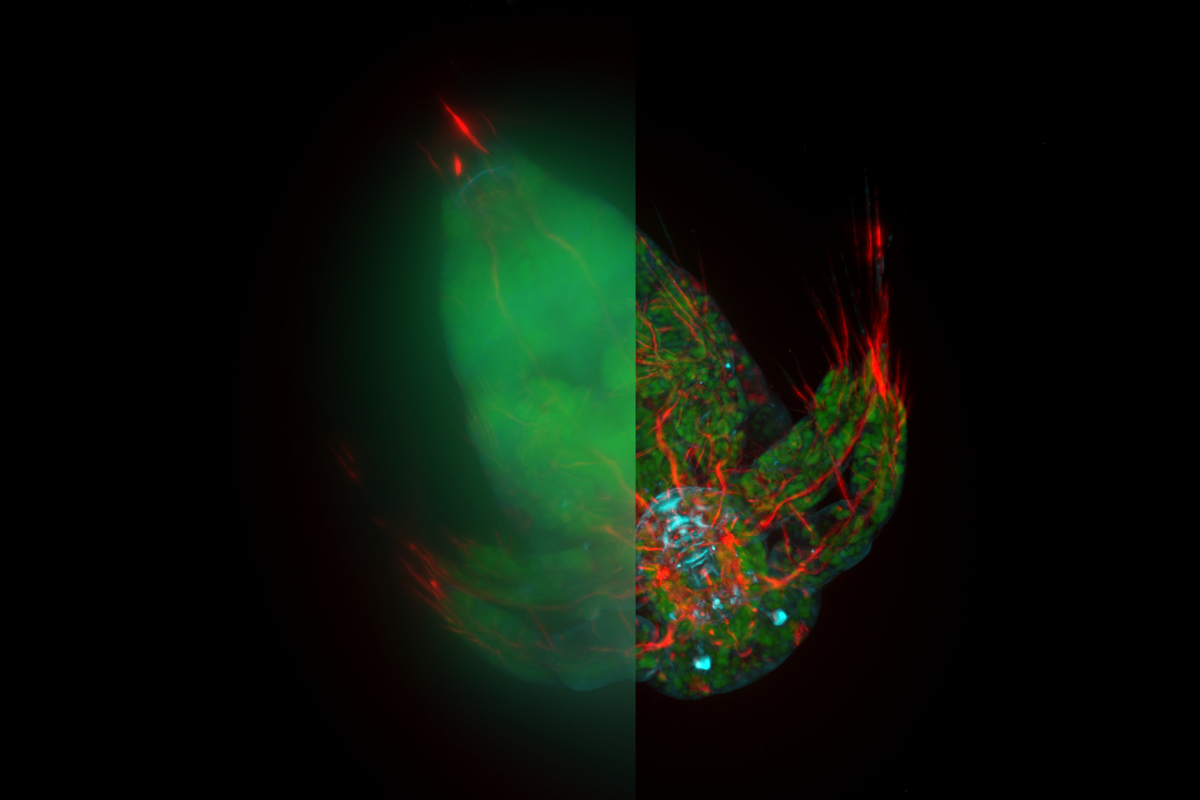
図1:マウス脊髄切片のスクリーニング
画像A)では、従来の蛍光顕微鏡観察像(Rawデータ)をMIP (max intensity projection)で表示しています。また、画像B)では、画像A)のRawデータをLVCC (Large Volume Computational Clearing)で処理したMIPを示しています。切断され不活性となった軸索は緑色を、再接続され活性化した軸索は赤色を呈していることが分かります。
結論
THUNDER画像により軸索スクリーニングが高速化されるということが明らかとなりました。図1では、従来の蛍光顕微鏡画像と比べてTHUNDER画像の方が赤色を呈する活性化した軸索と緑色を呈する不活性な軸索のそれぞれの位置とその数が、より鮮明に判別できることが示されました。この結果から、THUNDER画像は軸索の迅速なスクリーニングを可能とし、AGIの抑制の有効性をより効率的に判定することができる可能性が示唆されました。
AGIタンパク質の抑制により得られる脳および脊髄の外傷・疾患の予後に効果的であるということを示唆する研究の早期進展が、より適した治療法のいっそうの進展を促進させます。
参考文献
1)Y. Zou, M. Stagi, X. Wang, K. Yigitkanli, C.S. Siegel, F. Nakatsu, W.B.J. Cafferty, S.M. Strittmatter, Gene-Silencing Screen for Mammalian Axon Regeneration Identifies Inpp5f (Sac2) as an Endogenous Suppressor of Repair after Spinal Cord Injury, Journal of Neuroscience (2015) vol. 35, is. 29, pp. 10429-10439, DOI: 10.1523/JNEUROSCI.1718-15.2015
2)K.L. Fink, S.M. Strittmatter, W.B.J. Cafferty, Comprehensive Corticospinal Labeling with mu-crystallin Transgene Reveals Axon Regeneration after Spinal Cord Trauma in ngr1−/− Mice, Journal of Neuroscience (2015) vol. 35, iss. 46, pp. 15403-15418, DOI: 10.1523/JNEUROSCI.3165-15.2015
3)K.L. Fink, W.B.J. Cafferty, Reorganization of Intact Descending Motor Circuits to Replace Lost Connections After Injury, Neurotherapeutics (2016) vol. 13, iss. 2, pp. 370–381, DOI: 10.1007/s13311-016-0422-x
ライカは、お客様のご研究に合った蛍光イメージングソリューションをご提案いたします。ぜひ、お気軽にお問い合わせください!
- 蛍光顕微鏡のニューノーマル
- THUNDERイメージャー
蛍光顕微鏡で画像を取得する際に発生してしまう、蛍光「ボケ」を徹底的に取り除き、驚くほどシャープでクリアな画像を得ることができる最新鋭の蛍光イメージングシステムTHUNDERイメージャー。複雑な挙動を示す生体サンプルの蛍光ボケさえも、リアルタイムに分離・除去します。培養細胞からモデル生物まで、幅広いサンプルを「超」高精細に観察することができ、これまでのソフトウェアやハードウェアよりもアーティファクトの無い画像を素早く、簡単に取得できるのが特徴です。